Olimpiade Sains Kota (OSK) 2014 - Kimia , Nomor 29
Karbon disulfida, CS2, pada suhu 46 oC merupakan pelarut yang sangat baik untuk melarutkan belerang dan senyawa lainnya. Namun penggunaan senyawa ini di laboratorium sudah mulai dikurangi karena beracun dan sangat mudah terbakar.
a. Gambar berikut menunjukkan cara untuk membuat salah satu alotrop dari belerang.
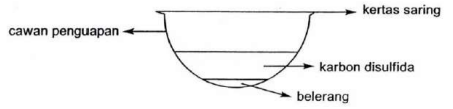
i. Gambarkan struktur Lewis karbon disulfida dan tuliskan bentuk geometrinya.
ii. Tuliskan rumus molekul dan gambar struktur suatu alotrop molekul belerang.
iii. Jelaskan mengapa belerang dapat larut dalam karbon disulfida
b. Salah satu bahaya dalam penggunaan karbon disulfida adalah bahwa senyawa tersebut sangat cepat menyala dan terbakar ketika berkontak dengan udara sesuai reaksi berikut (belum setara): CS2(l) + O2(g) CO2(g) + SO2(g)
i. Setarakan persamaan reaksi di atas.
ii. Hitung volum total gas yang dihasilkan (pada 20 oC dan 1 atm) jika sebanyak 25 mL karbon disulfida cair dibakar sempurna. Diketahui kerapatan karbon disulfida adalah 1,26 g/mL pada 20 oC.
iii. Hitung massa gas CO2 dan SO2 (dalam gram) yang dihasilkan pada reaksi dalam soal (b.ii)
c. Dalam proses ekstraksi dikenal suatu tetapan yang disebut koefisien partisi, Kd, yaitu perbandingan antara konsentrasi zat terlarut dalam pelarut pada fasa bagian atas terhadap konsentrasi zat terlarut dalam pelarut pada fasa bagian bawah. Satuan konsentrasi yang lain digunakan adalah g zat terlarut/mL pelarut. Koefisien partisi Kd untuk iod (I2) dalam pelarut air dan karbon disulfida pada 20 oC adalah 2,4 x 10–3 . Diketahui kerapatan air adalah 1,00 g/mL dan kerapatan karbon disulfida adalah 1,26 g/mL pada suhu 20 oC. Sebanyak 100 mL sampel larutan ion dalam air dengan konsentrasi 5,0 x 10–4 M diekstraksi dengan 20 mL karbon disulfida.
i. Tuliskan ungkapan Kd untuk ion dalam soal di atas.
ii. Hitung massa iod yang dapat diekstraksi oleh karbon disulfida.
iii. Jelaskan mana kelarutan iod yang lebih besar, apakah dalam air atau dalam karbon disulfida?
